¿Qué son las contramedidas médicas?
Las contramedidas médicas o MCM, son productos regulados por la FDA que pueden usarse en el caso de que ocurran posibles emergencias
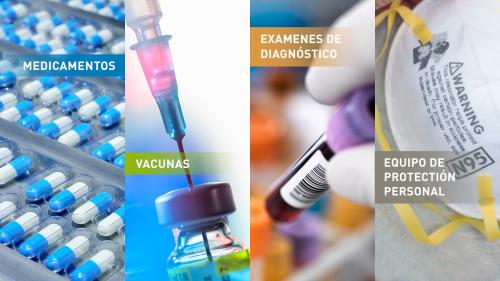
Las contramedidas médicas o MCM, son productos regulados por la FDA (biológicos, farmacéuticos, dispositivos) que pueden usarse en el caso de que ocurran posibles emergencias de salud pública a consecuencia de un ataque terrorista con material biológico, químico o radiológico/nuclear, una enfermedad emergente de carácter natural o un desastre natural.
Las MCM pueden usarse para diagnosticar, prevenir, tratar o protegerse contra afecciones relacionadas con amenazas de tipo nuclear, radiológico, biológico y químico (NRBQ), o enfermedad infecciosas emergentes.
Las MCM pueden incluir:
- Productos biológicos, como vacunas, hemoderivados y anticuerpos
- Medicamentos, como fármacos antimicrobianos o antivíricos
- Dispositivos, incluyendo pruebas de diagnóstico para identificar agentes que presentan una amenaza y equipos de protección individual (EPI), como guantes, respiradores (máscaras) y ventiladores
¿Cuál es la función de la FDA en el desarrollo de las contramedidas médicas?
A través de la Iniciativa de Contramedidas Médicas (MCMi, por sus siglas en inglés) de la FDA, la FDA colabora con socios a todos los niveles del gobierno —local, estatal, nacional e internacional— para apoyar los esfuerzos de preparación y respuesta en materia de salud pública. La FDA forma parte de la Iniciativa de Contramedidas Médicas de Emergencia de Salud Pública (PHEMCE, por sus siglas en inglés) del Departamento de Salud y Servicios Sociales (HHS, por sus siglas en inglés) de los EE. UU., que coordina las actividades relacionadas con las MCM del HHS y los socios interinstitucionales del gobierno.
La FDA también trabaja con organizaciones no gubernamentales, universidades y centros de investigación, así como con la industria para seguir desarrollando MCM a fin de mejorar la preparación para hacer frente a las emergencias de salud pública.
¿Cómo se obtiene acceso y se usan las MCM durante las emergencias?
ependiendo de la emergencia y de las necesidades en materia de salud pública, durante una emergencia de salud pública, las MCM pueden obtenerse de la Reserva Estratégica Nacional (SNS, por sus siglas en inglés), la cual está supervisada por los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) o de las reservas estatales y locales, así como de otros almacenes farmacéuticos. Las MCM suelen proporcionarse o administrarse por trabajadores de atención médica y rescatistas de salud pública que actúan según los planes de respuesta de emergencia federales, estatales y/o locales.
En algunos casos, cuando se produce una emergencia de salud pública, la FDA puede aprobar las MCM y éstas se usarán de la manera autorizada durante una respuesta. Algunas MCM podrían no haberse aprobado todavía, o quizás sí se hayan aprobado pero no para el motivo indicado que se tiene en cuenta durante la emergencia.
Debido a su función en la regulación de productos médicos, así como de la naturaleza de algunos de estos productos, la FDA podría necesitar usar autorizaciones especiales para permitir el uso de tales MCM en las poblaciones afectadas durante las emergencias o en anticipación a ellas. Algunos de los mecanismos que la FDA puede utilizar para permitir el uso de emergencia de las MCM son las autorizaciones de uso de emergencia (EUA, por sus siglas en inglés) así como otras relacionadas con el uso de emergencia de MCM aprobadas.
¿Qué es la regla animal?
Antes de que un producto médico pueda ser aprobado por la FDA, el patrocinador debe demostrar su eficacia; es decir, que el producto funciona. En algunos casos, como en el del desarrollo de MCM para hacer frente a posibles amenazas de bioterrorismo, los estudios en humanos (en los que se expone a seres humanos al agente peligroso) no serían éticos ni posibles.
En estos casos, la FDA puede conceder la aprobación basándose en estudios bien controlados en animales cuando los resultados establezcan que el medicamento o producto biológico tiene una probabilidad elevada de producir resultados clínicos beneficiosos en los seres humanos. El patrocinador del producto aún debe demostrar la seguridad del producto en los seres humanos. Visite la página informativa sobre la regla animal de la FDA para obtener más información.
¿Aún tiene preguntas? Escriba un mensaje de correo electrónico a AskMCMi@fda.hhs.gov.
Información adicional
- Recursos sobre las contramedidas médicas
Enlaces de la FDA, HHS y otros socios gubernamentales - Enlaces sobre MCMi solicitadas frecuentemente
Enlaces relacionados con las MCM, ordenados por los grupos a los que se dirigen - Componentes de la mision PHEMCE
La misión PHEMCE es mejorar la preparación de la nación ante las amenazas de tipo natural, accidental e intencional mediante la coordinación de las contramedidas médicas dentro de HHS y encooperación con los socios interinstitucionales de PHEMCE - Información sobre la regla animal
Página de información sobre la regla animal de la FDA, incluyendo enlaces a las últimasn guías y presentaciones

