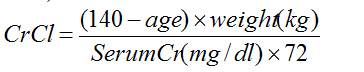Comunicado de la FDA sobre la seguridad de los medicamentos: Riesgo de convulsiones en pacientes con esclerosis múltiple que toman Ampyra (dalfampridine)
Anuncio de seguridad
Información adicional para pacientes
Información adicional para profesionales de la salud
Resumen de datos
Referencia
El 23 de julio, 2012, La Administración de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) está dando a conocer a los profesionales de la salud y al público la información más actualizada sobre el riesgo de convulsiones en pacientes con esclerosis múltiple (EM) que están comenzando a tomar Ampyra (dalfampridine). Usando información recibida de informes de eventos adversos posteriores a la comercialización, la FDA recientemente evaluó el riesgo de convulsiones en pacientes con esclerosis múltiple que están tomando Ampyra (dalfampridine). La mayoría de las convulsiones sucedieron al cabo de días o semanas después de comenzar a tomar la dosis recomendada y ocurrieron en pacientes sin una historia de convulsiones (ver Resumen de datos).
|
Datos sobre (Ampyra) dalfampridine |
|
Además, la FDA está actualizando la etiqueta del medicamento Ampyra para clarificar las recomendaciones de que se debe examinar la función renal en pacientes antes de comenzar a tomar Ampyra y controlarse por lo menos anualmente mientras el tratamiento con Ampyra continúa. Además, los pacientes que dejan de tomar una dosis no deben tomar ninguna dosis adicional; una dosis extra de Ampyra puede aumentar el riesgo de convulsiones.
Las convulsiones son un efecto secundario conocido de Ampyra, y el riesgo de convulsiones se incrementa con el aumento del medicamento en la sangre. Ampyra se elimina del cuerpo por medio de los riñones, y los pacientes con insuficiencia renal pueden tener un nivel más alto del medicamento en la sangre, lo que aumenta su riesgo de convulsiones. Ampyra no se debe usar en pacientes con una historia de convulsiones o que tienen insuficiencia renal (de los riñones) moderada o severa (medida como depuración de creatinina [CrCl] inferior o equivalente a 50 mL/min).
En pacientes con insuficiencia renal leve (CrCl 51-80 mL/min), el nivel de Ampyra en la sangre puede alcanzar un nivel relacionado con mayor riesgo de convulsiones. Por lo tanto, en los pacientes con insuficiencia renal leve, Ampyra requiere que se sopesen detenidamente los beneficios potenciales del tratamiento como también el riesgo potencial de convulsiones.
La FDA les recuerda a los profesionales de la salud que la función renal puede disminuir con la edad, y que la insuficiencia renal leve es común después de los 50 años, incluso cuando la creatinina en suero es normal. Se debe evaluar el funcionamiento de los riñones calculando la depuración de creatinina (ver Resumen de datos).
Información adicional para pacientes
- Ampyra puede causar convulsiones, incluso si nunca antes ha tenido convulsiones.
- Deje de tomar Ampyra y llame a su médico de inmediato si tiene convulsiones.
- La probabilidad de tener convulsiones es más alta si toma un exceso de Ampyra o si tiene insuficiencia renal. La disminución del funcionamiento renal es común después de los 50 años de edad.
- Notifique a su profesional de la salud si tiene problemas con los riñones.
- Su profesional de la salud debe ordenar análisis de sangre periódicamente para evaluar su funcionamiento renal.
- No tome Ampyra si alguna vez ha tenido convulsiones.
- Lea la Guía sobre el Medicamento que acompaña su Ampyra recetado.
- Las tabletas de Ampyra se deben tomar enteras y no se deben dividir, aplastar, mascar ni disolver.
- No tome dosis dobles ni dosis adicionales de Ampyra si deja de tomar una dosis. Los efectos secundarios, incluyendo las convulsiones, son más frecuentes con una dosis más alta.
- No tome dosis dobles ni dosis adicionales de Ampyra si deja de tomar una dosis. Los efectos secundarios, incluyendo las convulsiones, son más frecuentes con una dosis más alta.
- Consulte cualquier duda que tenga sobre Ampyra con su profesional de la salud.
- Reporte cualquier efecto secundario que tenga al programa MedWatch de la FDA usando la información en la sección "Contáctenos" en la parte inferior de esta página.
Información adicional para profesionales de la salud
- Ampyra está contraindicado en pacientes con una historia de convulsiones o insuficiencia renal moderada o severa (CrCl < 50="">
- La insuficiencia renal leve es común después de los 50 años.
- Se deben sopesar detenidamente los beneficios potenciales del tratamiento con Ampyra y el riesgo de convulsiones antes de usar Ampyra en pacientes con insuficiencia renal leve (CrCl 51-80 mL/min).
- La mayoría de las convulsiones reportadas con el tratamiento con Ampyra se presentaron en pacientes sin una historia de convulsiones.
- Se debe conocer el CrCl del paciente (que se calcula usando la ecuación Cockroft-Gault) antes de iniciar el tratamiento con Ampyra y se debe controlar por lo menos anualmente mientras el tratamiento con Ampyra continúa, incluso cuando el nivel de creatinina en suero parece ser normal.
- La dosis máxima recomendada de Ampyra es 10 mg dos veces al día (que se toman cada 12 horas). Las tabletas de Ampyra se deben tomar enteras y no se deben dividir, aplastar, mascar ni disolver.
- Dígale a los pacientes que no deben tomar dosis dobles ni dosis adicionales de Ampyra si dejan de tomar una dosis. Los efectos adversos, incluyendo las convulsiones, son más frecuentes con dosis más altas.
- Se debe dejar de tomar Ampyra permanentemente si se producen convulsiones.
- Reporte eventos adversos relacionados con Ampyra al programa MedWatch de la FDA usando la información en la sección "Contáctenos" en la parte inferior de esta página
Las convulsiones son un efecto secundario conocido de Ampyra, y el riesgo de convulsiones se incrementa con el aumento del medicamento en la sangre. Usando información del Sistema de Informes sobre Eventos Adversos AERS por sus siglas en inglés), la FDA evaluó más el riesgo de convulsiones en pacientes con esclerosis múltiple que toman Ampyra (dalfampridine). El análisis de la FDA identificó informes de casos posteriores a la comercialización de convulsiones relacionados con Ampyra con la dosis recomendada en la etiqueta, y muchos de los casos de convulsiones ocurrieron durante la primera semana de tomar Ampyra. La gran mayoría de las convulsiones ocurrieron en pacientes sin una historia de convulsiones. Algunos pacientes habían estado tomando otros medicamentos que podrían haber aumentado el riesgo de convulsiones u ocasionar que las convulsiones se produjeran con una menor cantidad de medicamento. Potencialmente, la insuficiencia renal relacionada con la edad y los aumentos resultantes en concentraciones de Ampyra en la plasma contribuyeron al riesgo de convulsiones.
La insuficiencia renal leve es común después de los 50 años, incluso si el nivel de creatinina en el suero está dentro de los límites normales. La FDA señaló que los pacientes que tuvieron convulsiones tenían por lo menos 50 años de edad y tenían un riesgo relacionado con su edad de insuficiencia renal. En pacientes con insuficiencia renal leve (CrCl 51-80 mL/min), el nivel de Ampyra en la sangre puede alcanzar un nivel que se ha relacionado con un riesgo más alto de convulsiones. Se deben sopesar detenidamente los beneficios potenciales del tratamiento con Ampyra y el riesgo de convulsiones antes de usar Ampyra en pacientes con insuficiencia renal leve.
Antes de iniciar el tratamiento con Ampyra, se debe evaluar la función renal; si se desconoce el CrCl, se puede calcular usando la ecuación Cockcroft-Gault (se multiplica por 0,85 en el caso de las mujeres):
Se considera que los pacientes con depuración de creatinina de 51-80 mL/min tienen insuficiencia renal leve y tienen mayor riesgo de convulsiones cuando toman Ampyra. El uso de Ampyra está contraindicado en pacientes con una depuración de creatinina de ≤ 50 mL/min.
- Acorda Therapeutics, respuesta a la solicitud de información de la FDA con fecha 11 de julio del 2012, presentada el 11 de julio del 2012.
| La FDA reconoce la importancia de proveer información relacionada a la seguridad de medicamentos en otros idiomas además del inglés. Haremos nuestro mejor esfuerzo para proveer versiones de nuestras comunicaciones de seguridad de medicamentos en español que sean precisas y oportunas. Sin embargo, de haber alguna discrepancia entre la versión en inglés y la versión en español, la versión en inglés debe ser considerada la versión oficial. Si usted tiene cualesquier pregunta o desea hacer algún comentario, favor de ponerse en contacto con Division of Drug Information en druginfo@fda.hhs.gov. |
Contáctenos
Para informar de un problema serio 1-800-332-1088 1-800-FDA-0178 Fax MedWatch Online Correo normal: Use el formulario pre franqueado FDA Form 3500B Enviar por correo a: MedWatch 5600 Fishers Lane Rockville, MD 20857 |