Investigación del brote de botulismo infantil: fórmula infantil (noviembre 2025)
No utilice la fórmula infantil ByHeart Whole Nutrition retirada del mercado. La investigación de la FDA continúa en curso.
Producto:
Todos los productos de fórmula infantil ByHeart Whole Nutrition han sido retirados del mercado. Esto incluye todos los lotes no vencidos de latas de fórmula y paquetes pequeños de una porción individual llamados “Anywhere Packs”.
Los productos de fórmula infantil de ByHeart representan aproximadamente el 1 % de toda la fórmula infantil vendida en los Estados Unidos, y este brote no genera preocupaciones de escasez de fórmula infantil para padres y cuidadores.
Síntomas del botulismo infantil (en inglés)
La mayoría de los bebés con botulismo infantil desarrollan inicialmente estreñimiento, pérdida de apetito, pérdida del control de la cabeza y dificultad para tragar, síntomas que pueden progresar a dificultad respiratoria y a un paro respiratorio. Los síntomas del botulismo infantil, que se diagnostican clínicamente, pueden tardar varias semanas en aparecer después de la ingestión de la fórmula.
Tiendas afectadas
La fórmula infantil ByHeart Whole Nutrition estaba disponible para su venta en línea y en las principales tiendas minoristas de todo el país. Se ha retirado del mercado toda la fórmula infantil ByHeart, por lo que, aunque los consumidores la encuentren disponible para la venta, no deben comprarla.
Estado de la investigación
En curso. Consulte las Medidas de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) para responder ante la enfermedad causada por Clostridium botulinum, asociada con el consumo de fórmula infantil en polvo, para obtener más información sobre las medidas de la FDA para garantizar la inocuidad de este producto.
Recomendaciones
- Los padres, madres y cuidadores deben dejar de usar inmediatamente cualquier producto de fórmula infantil ByHeart.
- Si su hijo consumió fórmula ByHeart y presenta síntomas (vea más abajo), busque atención médica de inmediato.
- Si su hijo consumió la fórmula y no presenta síntomas, continúe observándolo y busque atención médica si los síntomas aparecen.
- Los padres, madres y cuidadores que tengan preocupaciones sobre este brote y el botulismo infantil también pueden comunicarse con la línea directa del Departamento de Salud Pública de California (CDPH, por sus siglas en inglés) al 1-833-398-2022 (disponible de lunes a viernes de 7 a.m. a 7 p.m., hora del Pacífico).
- Lave los objetos y superficies que puedan haber estado en contacto con la fórmula usando agua caliente y jabón o en el lavavajillas.
- Las tiendas minoristas deben asegurarse de que el producto retirado del mercado no se encuentre en los estantes de las tiendas, incluido el producto devuelto por los clientes.
- El botulismo puede ser mortal, por lo que se deben tomar medidas de inmediato. Si su hijo consumió la fórmula ByHeart y presenta signos y síntomas de botulismo, como falta de apetito, pérdida del control de la cabeza, dificultad para tragar o disminución de la expresión facial, busque atención médica inmediata.
- Si usted es médico y sospecha que un paciente infantil podría tener botulismo, llame de inmediato a la línea de asistencia clínica del CDPH al 510-231-7600 para consultar el caso. El servicio de consulta está disponible las 24 horas del día, los 7 días de la semana.
Última actualización
23 de enero de 2026
La FDA y los Centros para el Control y Prevención de Enfermedades (CDC, por sus siglas en inglés), en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP, por sus siglas en inglés) del CDPH y otros colaboradores estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Los análisis epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition es la fuente de este brote de botulismo infantil que afecta a varios estados. No se han añadido nuevos casos a la investigación desde el 10 de diciembre de 2025.
La FDA, los CDC, los colaboradores estatales y ByHeart están llevando a cabo muestreos y análisis del producto. Además, la FDA recogió muestras de los ingredientes de ByHeart para analizarlas, como parte de la investigación.
Al 23 de enero de 2026, dos muestras han dado positivo para Clostridium botulinum (toxina), tipo A. Una de ellas es una muestra del producto de fórmula infantil en polvo ByHeart. La otra es una muestra de leche en polvo, un ingrediente que ByHeart utiliza en la producción de la fórmula infantil en polvo ByHeart Whole Nutrition, que recopiló la FDA de un proveedor de ByHeart y cuyo análisis lo realizó el New York Wadsworth Laboratory [Laboratorio Wadsworth de Nueva York]. Según el análisis de secuenciación del genoma completo (WGS, por sus siglas en inglés), la bacteria Clostridium botulinum encontrada en la muestra de leche en polvo coincide genéticamente con la bacteria Clostridium botulinum detectada en la muestra del producto final de la fórmula infantil ByHeart. ByHeart también ha compartido públicamente los resultados de nuestras propias pruebas genéticas, que representan una segunda coincidencia genética concreta entre el ingrediente de leche en polvo, la fórmula ByHeart terminada y una muestra clínica compartida por los CDC de un niño con botulismo infantil.
Anteriormente, el 23 de diciembre de 2025, ByHeart informó públicamente los resultados positivos encontrados en las pruebas de Clostridium botulinum en seis de las 36 muestras del producto terminado. Estas seis muestras se tomaron de dos lotes (el lote 251261P2 y el lote 251131P2), ambos incluidos en el retiro del mercado inicial del producto.
El análisis de las muestras está en curso y los resultados se notificarán a medida que estén disponibles. La detección de Clostridium botulinum en la leche de fórmula infantil, o en sus ingredientes, es compleja y la confirmación de los resultados puede tardar varias semanas. Esto se debe en parte a las esporas resistentes al calor, que necesitan una activación especial antes de poder detectarlas. Además, para detectar C. botulinum en la fórmula infantil es necesario llevar a cabo pruebas especializadas y contar con equipos de laboratorio. Aunque se lleven a cabo pruebas de detección iniciales, un resultado preliminar positivo requiere pruebas de confirmación. Este complejo proceso puede tardar dos o más semanas para obtener los resultados finales. Hay un número limitado de laboratorios que cuentan con el equipo y los recursos especializados para realizar estas pruebas, lo que reduce aún más la capacidad de realizar pruebas. La FDA está trabajando con sus colaboradores para mejorar y actualizar estos métodos, de modo que los resultados puedan confirmarse y compararse con más facilidad entre las partes interesadas.
La investigación de la FDA se centra en obtener una comprensión más clara de los factores que contribuyen a este brote. Este es el primer brote documentado de botulismo en los Estados Unidos atribuido a fórmula infantil contaminada y existen diferencias fundamentales entre las bacterias formadoras de esporas, como Clostridium botulinum, y las bacterias vegetativas, como Cronobacter y Salmonella. Estas son consideraciones importantes, ya que la FDA sigue respondiendo a este brote y aplicando estrategias de reducción de riesgos de cara al futuro. La FDA ha establecido la página de las Medidas de la FDA para responder ante la enfermedad causada por Clostridium botulinum, asociada con el consumo de fórmula infantil en polvo, para reflejar los esfuerzos continuos con el fin de garantizar la inocuidad de la fórmula infantil en polvo, que incluye información general sobre la inocuidad de la fórmula.
Todos los productos de fórmula infantil ByHeart han sido retirados del mercado y no deberían estar disponibles para la venta en tiendas ni en línea. Esto incluye todas las latas de fórmula y los sobres individuales “Anywhere Pack”.
La FDA sigue recibiendo notificaciones de que la fórmula retirada sigue encontrándose en los estantes de las tiendas, a pesar de la retirada en curso de todos los productos de fórmula infantil ByHeart. La FDA sigue trabajando con los colaboradores estatales y las tiendas minoristas para garantizar un retiro del mercado eficaz y la eliminación inmediata de estos productos en las tiendas de todo el país. El 15 de diciembre de 2025, la FDA emitió un comunicado de prensa y recordó a la industria sus obligaciones legales en cuanto a los alimentos que se retiran del mercado en virtud de la Ley Federal de Alimentos, Medicamentos y Cosméticos. La FDA pidió a las empresas que siguieran las mejores prácticas al llevar a cabo el retiro de los productos. Esto es especialmente importante en el caso de los productos retirados relacionados con alimentos para bebés y niños pequeños, que se encuentran entre las poblaciones más vulnerables.
La investigación de la FDA sigue en curso y este aviso se actualizará a medida que se disponga de nueva información.
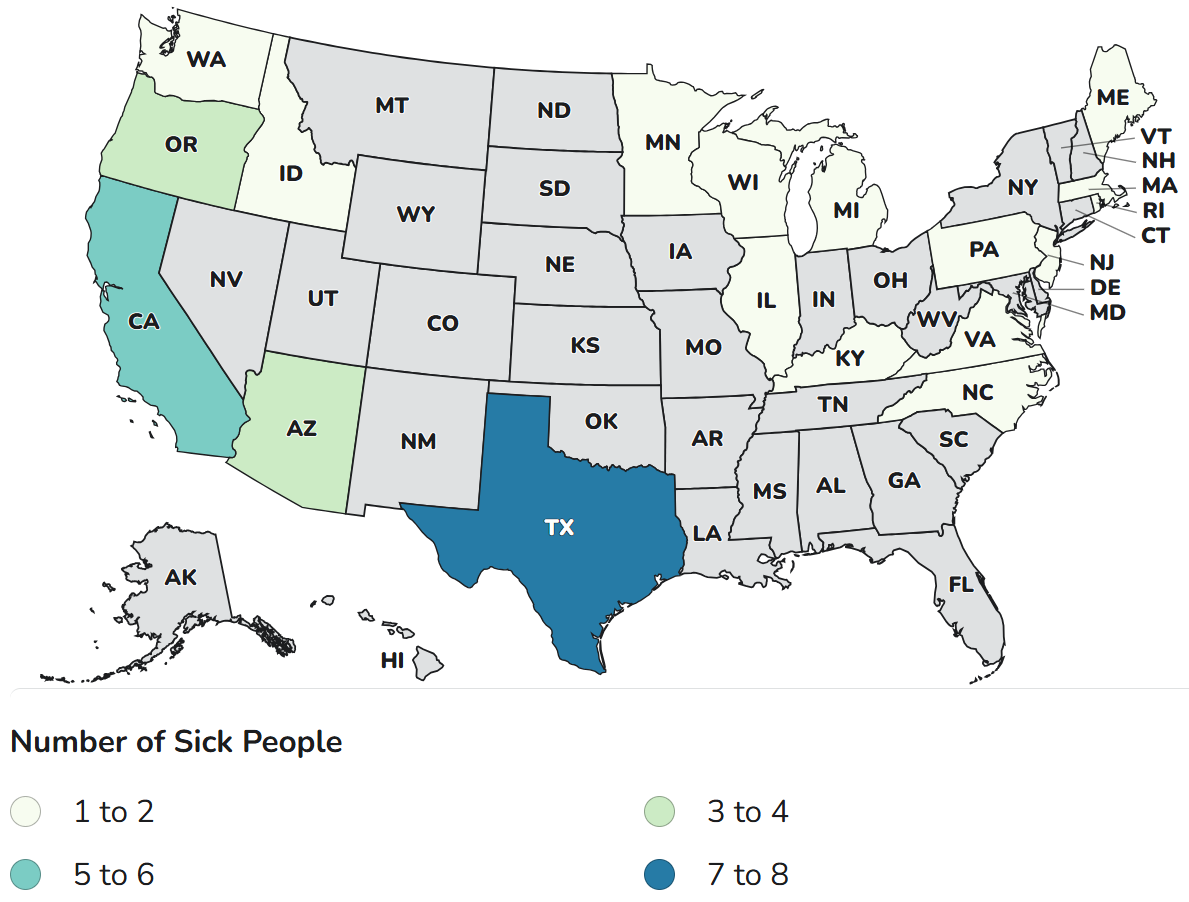
Mapa de recuento de casos de los CDC
Recuento de casos
Total de enfermedades: 51
Hospitalizaciones: 51
Muertes: 0
Última manifestación de la enfermedad: 1 de diciembre de 2025
Estados con casos: AZ, CA, ID, IL, KY, MA, ME, MI, MN, NC, NJ, OH, OR, PA, RI, TX, VA, WA, WI
Distribución del producto: en línea, a nivel nacional (incluidos Guam y Puerto Rico) e internacionalmente
Enlaces útiles
- Aviso de brote de los CDC
- Programa de Tratamiento y Prevención de Botulismo Infantil
- Anuncio de retiro ampliado de ByHeart
- Medidas de la FDA para responder ante la enfermedad causada por Clostridium botulinum, asociada con el consumo de fórmula infantil en polvo
- Consejos de inocuidad alimentaria para tiendas minoristas y consumidores durante un brote
- Recursos de inocuidad alimentaria para transportistas durante un brote de enfermedades transmitidas por alimentos
- A quién contactar
- ¿Qué es el botulismo?
Imágenes de los productos
Resultados de las muestras (última actualización: 23 de enero de 2026)
La FDA, los CDC, los colaboradores estatales y ByHeart están tomando muestras y haciendo análisis. La información disponible sobre muestras positivas se incluye a continuación. Esta tabla se actualizará a medida que haya resultados adicionales disponibles o que se compartan con la FDA.
Debido al gran número de muestras, aquí solo se notifican los resultados positivos en productos terminados. La detección de Clostridium botulinum en la fórmula infantil es compleja, y un resultado negativo no descarta la presencia de la bacteria en el producto.
Los padres, madres y cuidadores no deben usar ninguna fórmula infantil de la marca ByHeart, independientemente de los resultados de las pruebas.
Muestra recolectada/analizada por | Producto | Resultado de la muestra | Tipo de toxina |
CDPH | Envase abierto de fórmula infantil ByHeart (Lote n.° 251131P2) | Positivo | Tipo A |
ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
| ByHeart | Fórmula infantil ByHeart (lote 251261P2 o lote 251131P2) | Positivo | Tipo A |
| Recopilado por AZ/Analizado por LFFM de la FDA | Envase sin abrir de fórmula infantil ByHeart (lote n.º 251481P2) | Positivo | Tipo A |
Además, la FDA recogió muestras de los ingredientes de ByHeart para analizarlas, como parte de la investigación. Al 23 de enero de 2026, la muestra de un ingrediente analizada bajo el Modelo de Financiamiento Flexible de Laboratorio (LFFM, por sus siglas en inglés) de la FDA dio positivo para la toxina botulínica, tipo A: una muestra de leche en polvo, un ingrediente utilizado en la producción de la fórmula infantil en polvo ByHeart Whole Nutrition, recopilada por la FDA de un proveedor de ByHeart. Según el análisis de WGS, la bacteria Clostridium botulinum encontrada en la muestra de leche en polvo coincide genéticamente con la bacteria Clostridium botulinum detectada en la muestra del producto final de la fórmula infantil.
Distribución Internacional
El retiro de la fórmula infantil de ByHeart afecta mercados fuera de los Estados Unidos. La información de clientes proporcionada por Amazon muestra que una cantidad limitada de fórmula infantil de ByHeart retirada del mercado fue distribuida a Argentina, Brasil, Brunéi, Canadá, Chile, China, Colombia, Ecuador, Egipto, Hong Kong, Israel, Jamaica, Japón, República de Corea, Perú, Filipinas, Rumanía, Singapur, Sudáfrica, Tailandia y las Islas Vírgenes Británicas.
Los consumidores de todo el mundo no deben usar ninguna fórmula infantil de la marca ByHeart, ya que todos los productos de ByHeart están incluidos en este retiro.
Actualizaciones previas
17 de diciembre de 2025
La FDA y los CDC, en colaboración con el IBTPP del CDPH y otros colaboradores estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Los análisis epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition es la fuente de este brote de botulismo infantil que afecta a varios estados.
Desde la última actualización del 10 de diciembre de 2025, los informes de casos relacionados con este brote han disminuido y las autoridades de salud pública no han añadido ningún caso nuevo a esta investigación. En el futuro, en lugar de actualizaciones semanales, los CDC proporcionarán actualizaciones sobre la investigación de este brote cuando se disponga de nueva información. La FDA seguirá proporcionando actualizaciones sobre la investigación según sea necesario.
Todos los productos de fórmula infantil ByHeart han sido retirados del mercado y no deberían estar disponibles para la venta en tiendas ni en línea. Esto incluye todas las latas de fórmula y los sobres individuales “Anywhere Pack”. El 12 de diciembre de 2025, la FDA envió cartas de advertencia a cuatro importantes tiendas minoristas por no retirar de sus estantes la fórmula infantil ByHeart retirada del mercado, a pesar de haber recibido la notificación del retiro. El 15 de diciembre de 2025, la FDA emitió un comunicado de prensa y recordó a la industria sus obligaciones legales en cuanto a los alimentos que se retiran del mercado en virtud de la Ley Federal de Alimentos, Medicamentos y Cosméticos. La FDA pidió a las empresas que siguieran las mejores prácticas al llevar a cabo el retiro de los productos. Esto es especialmente importante en el caso de los productos retirados relacionados con alimentos para bebés y niños pequeños, que se encuentran entre las poblaciones más vulnerables.
ByHeart, la FDA, los CDC y los colaboradores estatales están realizando pruebas adicionales y se espera que los resultados estén listos en las próximas semanas. Los resultados positivos de las muestras para los análisis de productos terminados se incluirán y actualizarán en la sección “Resultados de las muestras” que figura a continuación.
10 de diciembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP) del Departamento de Salud Pública de California (CDPH) y otros colaboradores estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Los datos epidemiológicos y de laboratorio muestran que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, lo que está causando enfermedades infantiles en varias regiones del país.
Las investigaciones de ByHeart y la FDA sobre la causa principal del brote siguen en curso y, en este momento, la FDA no puede descartar la posibilidad de que la contaminación pueda haber afectado a todos los productos de fórmula de ByHeart. En respuesta, los CDC ampliaron la definición del caso y ahora incluye cualquier bebé con botulismo que haya estado expuesto a la fórmula ByHeart en cualquier momento desde el lanzamiento del producto en marzo de 2022. Al 10 de diciembre de 2025, se han notificado un total de 51 casos de bebés con sospecha o confirmación de botulismo infantil y exposición confirmada a la fórmula infantil ByHeart Whole Nutrition (varios lotes) en 19 estados (vea el mapa).
Anteriormente, el recuento de casos incluía las enfermedades registradas a partir del 1 de agosto de 2025. Con la ampliación de la definición del caso, los CDC y sus colaboradores estatales identificaron 10 casos adicionales anteriores que se produjeron entre diciembre de 2023 y julio de 2025. En este momento, no se han identificado casos entre marzo de 2022 y diciembre de 2023. Los 10 casos anteriores son casos confirmados de botulismo infantil con exposición documentada a la fórmula ByHeart.
La confirmación de laboratorio para algunos casos está en curso. Las enfermedades comenzaron entre el 24 de diciembre de 2023 y el 1 de diciembre de 2025. Los 51 bebés fueron hospitalizados y no se han registrado muertes hasta la fecha. Los bebés tienen entre 16 y 264 días y 22 (43 %) son niñas.
Las autoridades de salud pública estatales y locales están entrevistando a los cuidadores sobre los alimentos que les dieron a los bebés el mes anterior a que se enfermaran. Se han identificado 51 bebés que consumieron fórmula infantil en polvo ByHeart Whole Nutrition antes de enfermarse.
La FDA no ha recibido notificaciones de que se haya encontrado la fórmula retirada del mercado en las tiendas desde el 26 de noviembre de 2025. Todos los productos de fórmula infantil ByHeart han sido retirados del mercado y no deberían estar disponibles para la venta en tiendas ni en línea. Esto incluye todas las latas de fórmula y los sobres individuales “Anywhere Pack”.
ByHeart, la FDA, los CDC y los colaboradores estatales están realizando pruebas adicionales y se espera que los resultados estén listos en las próximas semanas. Los resultados positivos de las muestras para los análisis de productos terminados se incluirán y actualizarán en la sección “Resultados de las muestras” que figura a continuación.
3 de diciembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP) de Departamento de Salud Pública de California (CDPH), y otros colaboradores estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Datos epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, bacteria que está causando enfermedades en bebés lactantes de diversas regiones del país.
Hasta el 3 de diciembre de 2025, se han reportado un total de 39 casos de bebés con sospecha o confirmación de botulismo infantil y exposición confirmada a la fórmula infantil ByHeart Whole Nutrition (de varios lotes) en 18 estados (vea el mapa abajo). La confirmación de laboratorio para algunos casos aún está pendiente. Las enfermedades comenzaron en fechas que abarcan entre el 9 de agosto y el 19 de noviembre de 2025. Los 39 bebés fueron hospitalizados. Hasta la fecha, no se han notificado fallecimientos. De 38 bebés con información disponible de edad y 39 bebés con información del sexo, las edades varían entre 16 y 264 días, y 15 (38%) son de sexo femenino.
Las autoridades de salud pública estatales y locales están entrevistando a los cuidadores sobre los alimentos que se les dieron a los bebés en el mes previo a enfermarse. Se han identificado treinta y nueve bebés que fueron alimentados con la fórmula infantil en polvo ByHeart Whole Nutrition antes de enfermarse.
La FDA continúa recibiendo notificaciones de que la fórmula retirada del mercado aún se encuentra en los estantes de las tiendas Walmart, Target, Kroger, Acme y Shaw's, a pesar del retiro continuo de todos los productos de fórmula infantil de ByHeart. La FDA continúa trabajando con los colaboradores estatales y tiendas minoristas para garantizar un retiro efectivo y la eliminación inmediata de estos productos de las tiendas en todo el país. Todos los productos de fórmula infantil ByHeart han sido retirados del mercado y estos productos no deben estar disponibles para la venta en tiendas ni en línea. Esto incluye todas las latas de fórmula y sobres individuales “Anywhere Packs”.
Se están realizando pruebas adicionales por parte de ByHeart, la FDA, los CDC y los colaboradores estatales, y se esperan resultados en las próximas semanas. El 19 de noviembre, ByHeart informó que analizó 36 muestras de fórmula infantil en tres lotes, y cinco de ellas dieron positivo para Clostridium botulinum tipo A. ByHeart no ha informado públicamente sobre los lotes específicos analizados. Los resultados positivos de las muestras de los análisis del producto terminado se incluirán y actualizarán en la sección de Información de Muestras a continuación.
La investigación de la FDA continúa para determinar el punto de contaminación. Este aviso se actualizará a medida que se disponga de más información.
26 de noviembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP) de Departamento de Salud Pública de California (CDPH), y otros socios estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Datos epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, bacteria que está causando enfermedades en bebés lactantes de diversas regiones del país.
Hasta el 26 de noviembre de 2025, se han reportado un total de 37 bebés con botulismo infantil sospechado o confirmado y con exposición confirmada a la fórmula infantil de ByHeart Whole Nutrition (varios lotes) en 17 estados (ver mapa). La confirmación de laboratorio para algunos casos está pendiente. De los 36 casos con información disponible sobre el inicio de la enfermedad, los síntomas comenzaron entre el 9 de agosto y el 19 de noviembre de 2025. Los 37 bebés fueron hospitalizados. Hasta la fecha, no se han reportado muertes. De los 35 bebés con información disponible de edad y sexo, las edades varían entre 16 y 264 días, y 15 (43%) son de sexo femenino.
Las autoridades de salud pública estatales y locales están entrevistando a los cuidadores sobre los alimentos que se les dieron a los bebés en el mes previo a enfermarse. Se han identificado treinta y siete bebés que fueron alimentados con la fórmula infantil en polvo ByHeart Whole Nutrition antes de enfermarse.
La FDA ha recibido notificaciones de que la fórmula retirada del mercado aún se encuentra en estantes de tiendas en varios estados, incluso en múltiples ubicaciones de Walmart, Target y Kroger, y en una o más tiendas Sprouts Organic Market, Safeway, Acme, Jewel-Osco, Shaw’s, Star Market, Smith’s, King Sooper’s, Albertson’s, Whole Foods, Wegman’s y Publix. La FDA está con colaboradoes estatales y minoristas para garantizar un retiro efectivo y la eliminación inmediata de estos productos de los estantes de tiendas en todo el país. Todos los productos de fórmula infantil de ByHeart han sido retirados del mercado y estos productos no deben estar disponibles para la venta en tiendas ni en línea. Esto incluye todas las latas de fórmula y sobres individuales “Anywhere Packs”.
Se están realizando pruebas adicionales por parte de ByHeart, la FDA, los CDC y los colaboradores estatales, y se esperan resultados en las próximas semanas. Los resultados positivos de muestras serán incluidos y actualizados en la sección de Información de Muestras a continuación.
La investigación de la FDA, que incluye inspecciones in situ, continúa para determinar el punto de contaminación. La FDA está publicando los Informes de Inspección de Establecimientos (EIR) y los formularios FDA 483, Observaciones de Inspección, correspondientes a inspecciones completadas previamente entre 2022 y marzo de 2025 en las instalaciones de ByHeart. ByHeart, Inc. que es la empresa matriz de tres instalaciones de fabricación Blendhouse ubicadas en Allerton, Iowa; Portland, Oregón; y Reading, Pensilvania.
- Blendhouse Allerton: la instalación fue inspeccionada por última vez en febrero de 2025 y clasificada como Voluntary Action Indicated (VAI, por sus siglas en inglés), lo cual citó deficiencias en las GMP.
- Blendhouse Portland: la instalación fue inspeccionada por última vez en marzo de 2025 y clasificada como No Action Indicated (NAI, por sus siglas en inglés).
- Blendhouse Reading: la instalación fue inspeccionada por última vez en enero de 2024 y clasificada como Official Action Indicated (OAI, por sus siglas en inglés). Esta instalación no ha estado en operación desde septiembre de 2023.
20 de noviembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP) de Departamento de Salud Pública de California (CDPH), y otros colaboradores socios estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Datos epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, bacteria que está causando enfermedades en bebés lactantes de diversas regiones del país.
La FDA ha recibido reportes de que la fórmula retirada aún se encuentra en estantes de tiendas en varios estados, incluyendo múltiples ubicaciones de Walmart, Target y Kroger, así como en una o más tiendas Sprouts Organic Market, Safeway, Jewel-Osco, Shaw’s y Star Market. La FDA está trabajando con socios estatales y minoristas para garantizar un retiro eficaz y la eliminación inmediata de estos productos de los estantes en todo el país. Todos los productos de fórmula infantil ByHeart han sido retirados del mercado, y no deberían estar disponibles para la venta en tiendas o en línea. Esto incluye todas las latas de fórmula y paquetes pequeños de una porción individual llamados “Anywhere Packs”.
Además, el producto retirado se vendió a través de mercados en línea y fue enviado a clientes fuera de los Estados Unidos. Los consumidores en todo el mundo no deben usar ninguna fórmula infantil de la marca ByHeart, ya que todos los productos están incluidos en este retiro. Más información sobre la distribución internacional, incluida una lista de países donde los consumidores recibieron el producto retirado, está disponible a continuación.
Como parte de la investigación, ByHeart analizó productos de fórmula infantil sin abrir que se mantenían en sus instalaciones. Según ByHeart, el análisis de laboratorio de terceros identificó Clostridium botulinum en algunas de estas muestras, bacteria que produce la toxina que está enfermando a los bebés en este brote. ByHeart afirma que continuará investigando estos hallazgos y realizará pruebas continuas para identificar la fuente de la contaminación.
19 de noviembre de 2025
Hasta el 19 de noviembre de 2025, un total de 31 bebés con botulismo infantil sospechado o confirmado, y con exposición confirmada a la fórmula infantil en polvo ByHeart Whole Nutrition (varios lotes) han sido reportados en 15 estados (ver mapa). La confirmación de laboratorio para algunos casos está pendiente.
De los los 27 casos con información disponible sobre el inicio de la enfermedad, los síntomas comenzaron entre el 9 de agosto y el 13 de noviembre de 2025. Todos 31 bebés fueron hospitalizados. No se han reportado muertes hasta la fecha. De los 23 bebés con información de edad disponible, y 24 con información de sexo, las edades oscilan entre 16 y 200 días, y 11 (46%) son niñas.
Las autoridades de salud pública estatales y locales están entrevistando a los cuidadores sobre los alimentos que se les dieron a los bebés en el mes previo a la enfermedad. Se han identificado 31 casos de botulismo infantil que consumieron fórmula infantil en polvo de ByHeart Whole Nutrition antes de enfermar.
Como parte de esta investigación, las autoridades de varios estados han recolectado fórmula infantil sobrante para análisis. El 8 de noviembre de 2025, el Departamento de Salud Pública de California (CDPH) detectó preliminarmente la presencia de toxina botulínica tipo A en un cultivo de fórmula infantil en polvo ByHeart de una lata abierta (lote 206VABP/251131P2) que se le administró a un bebé con botulismo infantil confirmado por laboratorio. Trabajos adicionales del CDPH confirmaron la identificación de la bacteria Clostridium botulinum tipo A en el cultivo.
Como parte de sus inspecciones en las instalaciones, la FDA recolectó y está analizando muestras de producto sin abrir. El análisis continúa y los resultados se proporcionarán cuando estén disponibles.
Pruebas adicionales por parte de la FDA, los CDC y colaboradores socios estatales están en curso, y se esperan resultados en las próximas semanas. La detección de Clostridium botulinum en fórmula infantil es compleja, y un resultado negativo no descarta la presencia de la bacteria.
La investigación de la FDA continúa para determinar el punto de contaminación. Este aviso se actualizará a medida que se disponga de información adicional.
14 de noviembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención del Botulismo Infantil (IBTPP) de Departamento de Salud Pública de California (CDPH), y otros coladadores estatales y locales, continúan investigando un brote de botulismo infantil que afecta a varios estados. Datos epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, bacteria que está causando enfermedades en bebés lactantes de diversas regiones del país.
Hasta el 14 de noviembre de 2025, se han reportado un total de 23 casos de bebés con sospecha o confirmación de botulismo infantil y exposición confirmada a la fórmula infantil ByHeart Whole Nutrition (de varios lotes) en 13 estados (vea el mapa abajo). La confirmación de laboratorio para algunos casos aún está pendiente. En 22 casos con información disponible sobre el inicio de la enfermedad, los síntomas comenzaron entre el 9 de agosto y el 11 de noviembre de 2025. Los 23 bebés fueron hospitalizados. Hasta la fecha, no se han notificado fallecimientos. De los 22 bebés de los que se dispone de información sobre la edad y el sexo, las edades oscilan entre los 16 y los 200 días y 10 (45%) son mujeres.
Como parte de la investigación, las autoridades de varios estados recolectaron sobras de fórmula infantil para realizar pruebas. El 8 de noviembre de 2025, el Departamento de Salud Pública de California (CDPH) reportó los resultados preliminares que sugieren la presencia de bacterias productoras de toxina botulínica en una lata abierta de fórmula ByHeart (lote 206VABP/251131P2) que fue consumida por un bebé enfermo. Se están realizando pruebas adicionales y se esperan los resultados en las próximas semanas. La detección de Clostridium botulinum en la fórmula infantil es difícil, y un resultado negativo no descarta la presencia de la bacteria en el producto.
11 de noviembre de 2025
La FDA ha ampliado su recomendación para incluir todos los productos de fórmula infantil ByeHeart debido al número de bebés enfermos notificados que han consumido este producto, la identificación de códigos de lotes adicionales, la identificación de nuevos casos de sospecha de botulismo infantil y la muestra preliminar positiva recopilada y analizada por el IBTPP del CDPH.
La FDA y los CDC, en colaboración con el CIBTPP del CDPH y colaboradores estatales y locales, están investigando un brote en varios estados de botulismo infantil. Los datos epidemiológicos y de laboratorio indican que la fórmula infantil ByHeart Whole Nutrition podría estar contaminada con Clostridium botulinum, una bacteria que está causando enfermedades en bebés en varias regiones del país.
Hasta el 10 de noviembre de 2025, se han reportado 15 bebés con botulismo infantil sospechado o confirmado y exposición confirmada a la fórmula ByHeart Whole Nutrition (varios lotes) en 12 estados (ver mapa). La confirmación de laboratorio de algunos casos está en proceso. De los 14 casos con información sobre el inicio de la enfermedad, los síntomas comenzaron entre el 9 de agosto y el 10 de noviembre de 2025. Los 15 bebés fueron hospitalizados y no se han reportado muertes. De los 14 bebés con información sobre la edad y el sexo, las edades varían entre 16 y 157 días, y 7 (50%) son niñas.
Las autoridades estatales y locales de salud pública están entrevistando a los cuidadores sobre los alimentos que los bebés consumieron en el mes previo a enfermarse. Se identificaron 15 casos de botulismo infantil en bebés que fueron alimentados con fórmula en polvo ByHeart Whole Nutrition antes de enfermarse.
Según información del IBTPP, entre el 1 de agosto y el 10 de noviembre de 2025, 84 bebés en todo el país recibieron tratamiento para botulismo infantil. De ellos, 36 (43%) habían consumido alguna fórmula infantil en polvo.
Notablemente, más del 40% (15) de los bebés con exposición a fórmula en polvo consumieron la fórmula ByHeart Whole Nutrition. Esto demuestra que la marca ByHeart está desproporcionadamente representada entre los bebés enfermos, especialmente considerando que ByHeart representa aproximadamente el 1% de las ventas de fórmula infantil en los Estados Unidos. La investigación continúa y no se han identificado otras marcas de fórmula infantil ni exposiciones compartidas que representen riesgo para los bebés.
Como parte de la investigación, las autoridades de varios estados recolectaron sobras de fórmula infantil para realizar pruebas. El 8 de noviembre de 2025, el Departamento de Salud Pública de California (CDPH) reportó los resultados preliminares que sugieren la presencia de bacterias productoras de toxina botulínica en una lata abierta de fórmula ByHeart (lote 206VABP/251131P2) que fue consumida por un bebé enfermo. Se están realizando pruebas adicionales y se esperan los resultados en las próximas semanas. La detección de Clostridium botulinum en la fórmula infantil es difícil, y un resultado negativo no descarta la presencia de la bacteria en el producto.
La FDA ha estado en contacto con la empresa y ha solicitado la ampliación del retiro del mercado para incluir toda la fórmula ByHeart disponible. El 11 de noviembre de 2025, ByHeart amplió su retiro de todos los productos de fórmula infantil a nivel nacional, incluidas las latas y los sobres individuales. Este aviso se actualizará a medida que haya información adicional disponible. La investigación de la FDA continúa para determinar el punto de contaminación.
8 de noviembre de 2025
La FDA y los CDC, en colaboración con el Programa de Tratamiento y Prevención de Botulismo Infantil (IBTPP) del Departamento de Salud Pública de California (CDPH) y colaboradores estatales y locales, están investigando un brote en varios estados de 13 casos de botulismo infantil en 10 estados: Arizona, California (2), Illinois (2), Minnesota, Nueva Jersey, Oregón, Pensilvania, Rhode Island, Texas (2) y Washington. La confirmación de casos del laboratorio continúa y no se han reportado muertes. El IBTPP del CDPH reportó un aumento en infecciones por botulismo tipo A entre bebés que consumieron fórmula infantil en polvo ByHeart entre agosto y noviembre de 2025. Todos los 13 casos incluidos en este brote consumieron fórmula infantil en polvo de la marca ByHeart. Las autoridades han recolectado restos de fórmula en varios estados para realizar pruebas, cuyos resultados se esperan en las próximas semanas.
La FDA ha estado en contacto con la empresa y ha recomendado un retiro voluntario del producto debido al número de casos, la gravedad de la enfermedad y la fuerte evidencia epidemiológica. El 8 de noviembre de 2025, ByHeart, Inc. aceptó retirar dos lotes de la fórmula infantil Whole Nutrition (Lotes: 206VABP/251261P2 y 206VABP/251131P2) reportados como consumidos por los bebés afectados. La FDA continúa trabajando con la empresa para garantizar que todos los productos potencialmente afectados sean retirados del mercado.