Formas posológicas orales sólidas de liberación inmediata Cambios de escala y posteriores a la aprobación: documentación química, de fabricación y controles, de pruebas de disolución in vitro y bioequivalencia in vivo.
Guía para la industria
Formas posológicas orales sólidas de liberación inmediata Cambios de escala y posteriores a la aprobación: documentación química, de fabricación y controles, de pruebas de disolución in vitro y bioequivalencia in vivo
Centro de Evaluación e Investigación de Fármacos (CDER)
Noviembre de 1995
CMC 5
ÍNDICE
I. PROPÓSITO DE LA GUÍA 1
II. DEFINICIÓN DE TÉRMINOS 3
III. COMPONENTES Y COMPOSICIÓN 6
IV. CAMBIOS DE SITIO 14
V. CAMBIOS EN TAMAÑO DE LOTE
VI. FABRICACIÓN 20
VII. DISOLUCIÓN IN VITRO 25
VIII. ESTUDIOS DE BIOEQUIVALENCIA IN VIVO 26
IX. REFERENCIAS 28
APÉNDICE A: FÁRMACOS CON GAMAS TERAPÉUTICAS ANGOSTAS A-1
GUÍA PARA LA INDUSTRIA1
FORMAS POSOLÓGICAS ORALES SÓLIDAS DE LIBERACIÓN INMEDIATA
CAMBIOS EN ESCALA Y POSTERIORES A LA APROBACIÓN:
DOCUMENTACIÓN QUÍMICA, DE FABRICACIÓN Y CONTROLES, PRUEBAS DE DISOLUCIÓN IN VITRO Y BIOEQUIVALENCIA IN VIVO
I. PROPÓSITO DE LA GUÍA
Esta guía provee recomendaciones para patrocinadores de solicitudes de fármacos nuevos (NDA), solicitudes abreviadas de fármacos nuevos (ANDA) y solicitudes abreviadas de antibióticos (AADA) que proponen, durante el período posterior a la aprobación, cambiar: 1) los componentes o la composición; 2) el lugar de fabricación; 3) la escala de fabricación (aumento/reducción) y/o 4) la fabricación (proceso y equipos) de una formulación oral de liberación inmediata.
Esta guía es resultado de: 1) un taller acerca del aumento en escala de productos medicamentosos de liberación inmediata realizado por la Asociación Americana de Científicos Farmacéuticos en colaboración con la Convención Farmacopoyética de los Estados Unidos y la Administración de Alimentos y Drogas (FDA); 2) la investigación realizada por la Universidad de Maryland en Baltimore acerca de la química, la fabricación y los controles de productos medicamentosos de liberación inmediata bajo el Contrato de Investigación Manufacturera de la FDA/Universidad de Maryland; 3) la investigación acerca de la clasificación de fármacos realizada en la Universidad de Michigan y la Universidad de Uppsala acerca de la permeabilidad de las sustancias medicamentosas; y 4) el Grupo de Trabajo de Cambios en Escala y Posteriores a la Aprobación (SUPAC), establecido por el Comité Coordinador de Química, Fabricación y Controles del Centro de Evaluación e Investigación de Fármacos (CDER) para elaborar una guía acerca de los cambios en escala y otros cambios posteriores a la aprobación.
La guía define: 1) los niveles de cambio; 2) las pruebas de química, fabricación y controles recomendadas para cada nivel de cambio; 3) pruebas de disolución in vitro y/o pruebas de bioequivalencia in vivo para cada nivel de cambio; y 4) la documentación que debería respaldar el cambio. Para los cambios presentados en un "suplemento de cambios bajo realización" [21 CFR 314.70(c)], la FDA podrá, después de un examen de la información suplementaria, decidir que los cambios no pueden ser aprobados. Esta guía por lo tanto enuncia información que debería proporcionarse al CDER en la solicitud para asegurar la continuidad de las características de calidad y rendimiento del producto en una formulación posológica oral sólida de liberación inmediata para cambios especificados posteriores a la aprobación. Esta guía no comenta sobre la documentación de observancia/inspección que ya ha sido definida por la Oficina de Observancia del CDER o la Oficina de Asuntos Reglamentarios de la FDA ni la afecta de otro modo. Esta guía no afecta ningún cambio posterior a la aprobación fuera de los especificados. Para cambios no tratados en esta guía, o para cambios múltiples presentados individualmente o en un período corto, o donde no se especifica el número de lotes necesarios para las pruebas de estabilidad, los patrocinadores deberán contactar a la división de revisión del CDER apropiada o consultar otras guías/pautas del CDER para obtener información acerca de la documentación de pruebas y solicitudes.
21 CFR 314.70(a) establece que los solicitantes podrán realizar cambios en una solicitud aprobada según una guía, aviso o reglamento publicado en el Registro Federal que estipule una notificación menos onerosa del cambio (por ejemplo, mediante una notificación en el momento de presentar un suplemento o en el próximo informe anual). Esta guía permite una notificación menos onerosa de ciertos cambios posteriores a la aprobación dentro del significado de § 314.70(a).
Para cambios posteriores a la aprobación de formularios de posología de liberación inmediata que afectan los componentes y la composición, cambios en escala, cambios de sitio y cambios en los procesos o equipos de fabricación, esta guía reemplaza las recomendaciones de la sección 4.G de la Guía de políticas y procedimientos de la Oficina de Fármacos Genéricos 22-90 (11 de septiembre de 1990). Para cualquier otro cambio y forma posológica, esta guía no afecta las recomendaciones de la Guía 22-90.
II. DEFINICIÓN DE TÉRMINOS2
A. Lote
Una cantidad específica de un fármaco u otro material producido según una sola orden de fabricación durante el mismo ciclo de fabricación que pretende tener carácter y calidad uniformes, dentro de límites especificados [21 CFR 210.3(b)(2)].
B. Predio contiguo
Un sitio continuo o sin interrupciones o un conjunto de edificios en cuadras urbanas adyacentes.
C. Pruebas de disolución
Caso A: Disolución de Q = 85% en 15 minutos en 900 mililitros (mL) de clorhidrato (HCl) 0,1N, usando el Aparato 1 de la Farmacopea Estadounidense (USP) 711> a 100 revoluciones por minuto (rpm) o el Aparato 2 a 50 rpm.
Caso B: Perfil de disolución en puntos múltiples en el medio de la solicitud/el compendio a los 15, 30, 45, 60 y 120 minutos o hasta que se logre una asíntota para la formulación propuesta y actualmente aceptada.
Caso C: Perfiles de disolución en puntos múltiples realizados en agua, HCl 0,1N y medio tampón USP a un pH de 4,5, 6,5 y 7,5 (cinco perfiles distintos) para las formulaciones propuestas y actualmente aceptadas. Se deberá realizar un muestreo apropiado a los 15, 30, 45, 60 y 120 minutos hasta que o se disuelva el 90% del fármaco del producto medicamentoso o se logre una asíntota. Se puede usar un surfactante con la justificación apropiada.
D. Producto medicamentoso
Un producto medicamentoso es una forma posológica terminada (p.ej., comprimido, cápsula o solución) que contiene una sustancia medicamentosa, por lo general, aunque no necesariamente, en asociación con un ingrediente adicional o más [21 CFR 314.3(b)]. Una forma posológica oral sólida incluye comprimidos, comprimidos masticables, cápsulas y cápsulas de gelatina blanda.
E. Sustancia medicamentosa
Un ingrediente activo cuyo propósito es proveer actividad farmacológica u otro efecto directo en el diagnóstico, la cura, el alivio, el tratamiento o la prevención de una enfermedad, o afectar la estructura de cualquier función del cuerpo humano, pero no incluye los intermedios utilizados en la síntesis de tal ingrediente [21 CFR 314.3(b)].
F. Equipos
Equipos automatizados o no automatizados, mecánicos o no mecánicos, utilizados para fabricar el producto medicamentoso, incluyendo los equipos utilizados para empaquetar el producto medicamentoso.
G. Formulación
Un listado de los ingredientes y la composición de la forma posológica.
H. Justificación
Informes que contienen los datos científicos y la opinión profesional experta para corroborar las decisiones.
I. Sustancia medicamentosa nueva
Cualquier sustancia que, al usarse en la fabricación, el procesado o el empaquetado de un fármaco, hace que ese fármaco se convierta en un fármaco nuevo, pero no incluye los intermedios usados en la síntesis de tal sustancia [21 CFR 310.3(g)].
J. Principio operativo
Reglas o conceptos que gobiernan la operación del sistema.
K. Escala piloto
La fabricación ya sea de una sustancia medicamentosa o un producto medicamentoso por medio de un procedimiento plenamente representativo que simula el utilizado para la escala de fabricación real.
Para formas posológicas orales sólidas, por lo general se considera, como mínimo, que esto es la décima parte de la producción completa, o 100.000 comprimidos o cápsulas, según cuál sea más grande (véase el Registro Federal del jueves 22 de septiembre de 1994, 59 FR 48754-59).
L. Proceso
Una serie de operaciones y/o acciones usadas para producir un resultado deseado.
M. Gamas
La medida en la cual o los límites entre los cuales existe una variación aceptable.
N. Igual
Acorde en tipo, cantidad; sin cambiar en carácter o condición.
O. Aumento en escala
El proceso de aumentar el tamaño del lote.
P. Reducción en escala
El proceso de reducir el tamaño del lote.
Q. Similar
Con un parecido general.
R. Cuerpo significativo de información
Es probable que exista un cuerpo significativo de información acerca de la estabilidad del producto medicamentoso tras cinco años de experiencia comercial para entidades moleculares nuevas, o tres años de experiencia comercial para formas posológicas nuevas.
S. Validación
Establecimiento mediante evidencia documentada de un alto grado de seguridad de que un proceso específico producirá en forma constante un producto que cumpla sus especificaciones y atributos de calidad predeterminados. Un proceso de fabricación validado es uno cuyo cumplimiento de lo que propone o representa hacer está comprobado. La evidencia de validación se obtiene mediante la recolección y evaluación de datos, preferentemente desde la fase de desarrollo del proceso hasta la fase de producción inclusive. La validación necesariamente incluye la calificación del proceso (la calificación de materiales, equipos, sistemas, edificios y personal), pero también incluye el control de todo los procesos para lotes o ciclos repetidos.
III. COMPONENTES Y COMPOSICIÓN
Esta sección de la guía enfoca los cambios en excipientes del producto medicamentoso. Esta guía no trata los cambios en la cantidad de la sustancia medicamentosa. Los cambios en componentes o composición que tienen el efecto de agregar un nuevo excipiente o de suprimir un excipiente se definen en el Nivel 3 (definido a continuación), salvo lo indicado más adelante.
A. Cambios de Nivel 1
1. Definición de nivel
Los cambios de Nivel 1 son aquellos con poca probabilidad de tener un impacto detectable en la calidad y el rendimiento de la formulación.
Ejemplos:
a. Supresión o supresión parcial de un ingrediente cuyo propósito es afectar el color o sabor del producto medicamentoso; o un cambio en el ingrediente de la tinta de impresión por otro ingrediente aprobado.
b. Cambios en excipientes, expresados como un porcentaje (p/p) de la formulación total, menores o iguales a las siguientes gamas porcentuales:
| EXCIPIENTE | PORCENTAJE DE EXCIPIENTE (P/P) EN EL PESO TOTAL DE LA FORMA POSOLÓGICA DIANA |
|---|---|
Relleno Desintegrante Almidón Otro Aglutinante Lubricante
Otro Deslizante Talco Otro | _5_6 _3_1 _1 _0.5 _0.25 _1 _1
_0.1 _1 |
Estos porcentajes se basan en el supuesto de que la sustancia medicamentosa en el producto está formulada al 100% de lo marcado/la potencia. El efecto aditivo total de todos los cambios de excipientes no deberá superar el 5%. (Ejemplo: En un producto que consiste en el ingrediente activo A, lactosa, celulosa microcristalina y estearato magnésico, la lactosa y la celulosa microcristalina no deberán variar en más de un total absoluto del 5% (p.ej. la lactosa aumenta un 2,5% y la celulosa microcristalina disminuye un 2,5%) en relación con el peso de la forma posológica diana si ha de quedar dentro de la gama del Nivel 1).
Los componentes (activos y excipientes) de la formulación deberán tener objetivos numéricos que representen la composición nominal del producto medicamentoso en la cual se ha de basar todo cambio futuro en la composición del producto. Los cambios permisibles en la composición deberán basarse en la composición diana aprobada y no en cambios de Nivel 1 anteriores en la composición.
2. Documentación de las pruebas
a. Documentación química
Requisitos de liberación de la solicitud/el compendio y pruebas de estabilidad.
Pruebas de estabilidad: un lote de datos de estabilidad a largo plaza referidos en el informe anual.
b. Documentación de disolución
Ninguna además de los requisitos de la solicitud/el compendio.
c. Documentación de bioequivalencia in vivo
3. Documentación de presentación
Informe anual (toda la información, incluyendo los datos de estabilidad a largo plazo).
B. Cambios de Nivel 2
1. Definición de nivel
Los cambios de Nivel 2 son los que podrían tener un impacto significativo en la calidad y el rendimiento de la formulación. Las pruebas y la documentación para la presentación de un cambio de Nivel 2 varían según tres factores: gama terapéutica, solubilidad y permeabilidad. La gama terapéutica se define como angosta o no angosta. El Apéndice A provee un listado de fármacos con gamas terapéuticas angostas. La solubilidad del fármaco y la permeabilidad del fármaco se definen como altas o bajas. La solubilidad se calcula en base a la concentración mínima del fármaco, miligramos/mililitros (mg/mL), en la mayor concentración posológica, determinada en la gama fisiológica de pH (pH 1 a 8) y temperatura (37 ± 0,5EC). Los fármacos de alta solubilidad son aquellos con un volumen de dosis/solubilidad menor o igual a 250 mL. (Ejemplo: La solubilidad más baja del compuesto A ocurre a 37 ± 0,5EC, 1,0 mg-mL a pH 7, y se consigue en concentraciones de 100 mg, 200 mg y 400 mg. Este fármaco se consideraría un fármaco de baja solubilidad ya que su volumen de dosis/solubilidad es mayor de 250 mL (400 mg/1,0 mg/mL = 400 mL). La permeabilidad (Pe, centímetro por segundo) se define como la permeabilidad eficaz de la pared del yeyuno humano por un fármaco e incluye una resistencia aparente al transporte en masa a la membrana intestinal. Los fármacos de alta permeabilidad por lo general son aquellos con un grado de absorción mayor del 90% ante la ausencia de inestabilidad documentada en el sistema gastrointestinal, o aquellos cuyos atributos de permeabilidad se han determinado experimentalmente).
Ejemplos:
a. Cambio en la calidad técnica de un excipiente. (Ejemplo: Avicel PH102 versus Avicel PH200).
b. Cambios en los excipientes, expresados como porcentajes (p/p) de la formulación total, mayores que los que figuran arriba para un cambio de Nivel 1 pero menores o iguales a las siguientes gamas porcentuales (que representan un aumento dos veces mayor que los cambios de Nivel 1):
| EXCIPIENTE | PORCENTAJE DE EXCIPIENTE (P/P) EN EL PESO TOTAL DE LA FORMA POSOLÓGICA DIANA |
|---|---|
Relleno Desintegrante Almidón Otro Aglutinante Lubricante Ca o Estearato de Mg Otro Talco Otro | _10 _6 _2 _1 _0.5 _2 _2 _0.2 _2 |
Estos porcentajes se basan en el supuesto de que la sustancia medicamentosa en el producto medicamentoso está formulada al 100% de lo marcado/la potencia. El efecto aditivo total de todos los cambios de excipientes no deberá superar el 10%.
Los componentes (activos y excipientes) de la formulación deberán tener objetivos numéricos que representen la composición nominal del producto en la cual se ha de basar todo cambio futuro en la composición del producto. Los cambios permisibles en la composición deberán basarse en la composición diana aprobada y no en la composición en base a cambios anteriores de Nivel 1 o Nivel 2.
2. Documentación de las pruebas
a. Documentación química
Requisitos de liberación de la solicitud/el compendio y los registros de lotes.
Pruebas de estabilidad: 1 lote con 3 meses de datos de estabilidad acelerada en un suplemento y 1 lote de estabilidad a largo plazo.
b. Documentación de disolución
Caso A: Fármacos de alta permeabilidad, alta solubilidad
Disolución del 85% en 15 minutos en 900 mL de HCl 0,1N. Si un producto medicamentoso no cumple este criterio, el solicitante deberá realizar las pruebas descritas para el Caso B o C (a continuación).
Caso B: Fármacos de baja permeabilidad, alta solubilidad
Se deberá realizar un perfil de disolución en puntos múltiples en el medio de la solicitud/el compendio a los 15, 30, 45, 60 y 120 minutos o hasta lograr una asíntota. Los perfiles de disolución de las formulaciones propuestas y actualmente utilizadas del producto deberán ser similares.
Caso C: Fármacos de alta permeabilidad, baja solubilidad
Se deberá realizar perfiles de disolución en puntos múltiples en agua, HCl 0,1 N y medios tampones de USP a un pH de 4,5, 6,5 y 8,5 (cinco perfiles distintos) para las formulaciones propuestas y actualmente aceptadas. Se deberá realizar un muestreo adecuado a los 15, 30, 45, 60 y 120 minutos hasta que o se disuelva el 90% del fármaco del producto medicamentoso o se logre una asíntota. Se podrá utilizar un surfactante, pero sólo con una justificación apropiada. Los perfiles de disolución de las formulaciones propuestas y actualmente usadas de los productos deben ser similares.
c. Documentación de bioequivalencia in vivo
Ninguna: Si la situación no cumple la descripción del Caso A, Caso B o Caso C, se deberá hacer referencia a los cambios de Nivel 3.
3. Documentación de presentación
Suplemento con la aprobación anterior (toda la información, incluyendo datos de estabilidad acelerada); informe anual (datos de estabilidad a largo plazo).
C. Cambios de Nivel 3
1. Definición de nivel
Los cambios de Nivel 3 son aquellos con probabilidad de tener un impacto significativo en la calidad y el rendimiento de la formulación. La documentación de las pruebas y la presentación varían según los tres factores siguientes: gama terapéutica, solubilidad y permeabilidad.
Ejemplos:
a. Todo cambio cualitativo y cuantitativo en los excipientes de un fármaco terapéutico angosto más allá de las gamas señaladas en la Sección III.A.1.b.
b. Cualquier otro fármaco que no cumpla los criterios de disolución bajo la Sección III.B.2.b.
c. Cambios en las gamas de excipientes de fármacos de baja solubilidad, baja permeabilidad más allá de las señaladas en la Sección III.A.1.b.
d. Cambios en las gamas de excipientes de todos los fármacos más allá de las señaladas en la Sección III.B.1.b.
2. Documentación de las pruebas
a. Documentación química
Requisitos de liberación de la solicitud/el compendio y registros de lotes.
Cuerpo significativo de información disponible:
Un lote con tres meses de datos de estabilidad acelerada referidos en un suplemento; un lote de datos de estabilidad a largo plazo referidos en el informe anual.
Cuerpo significativo de información no disponible:
Hasta tres lotes con tres meses de datos de estabilidad acelerada referidos en un suplemento; un lote de datos de estabilidad a largo plazo referidos en el informe anual.
b. Documentación de disolución
Perfil de disolución del Caso B, según lo descrito en la Sección III.B.2.b.
c. Documentación de bioequivalencia in vivo
Estudio completo de bioequivalencia. Podrá haber una exención para el estudio de bioequivalencia con una correlación in vivo/in vitro aceptable verificada.
3. Documentación de presentación
Suplemento con la aprobación anterior (toda la información, incluyendo datos de estabilidad acelerada); informe anual (datos de estabilidad a largo plazo).
IV. CAMBIOS DE SITIO
Los cambios de sitio consisten en cambios en la ubicación del lugar de fabricación para instalaciones manufactureras, tanto de propiedad de la empresa como contratadas, y no incluyen ningún cambio en escala, cambio de fabricación (incluyendo el proceso y/o los equipos) ni cambio en componentes o composición. La Sección V de esta guía trata los aumentos en escala. Los nuevos lugares de fabricación deberán tener una inspección de Buenas Prácticas Manufactureras (CGMP) actual satisfactoria.
A. Cambios de Nivel 1
1. Definición de nivel
Los cambios de Nivel 1 consisten en cambios de sitio dentro de un establecimiento único, donde se utilizan los mismos equipos, procedimientos operativos normalizados (SOP), condiciones ambientales (p.ej., temperatura y humedad) y controles, así como personal común a ambos sitios de fabricación, y donde no se realiza ningún cambio en los registros de los lotes de fabricación, salvo información administrativa y el lugar del establecimiento. Común se define como empleados que ya trabajan en el predio y que tienen una experiencia adecuada con el proceso de fabricación.
2. Documentación de las pruebas
a. Documentación química
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
b. Documentación de disolución
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
c. Documentación de bioequivalencia in vivo
Ninguna.
3. Documentación de presentación
Informe anual.
B. Cambios de Nivel 2
1. Definición de nivel
Los cambios de Nivel 2 consisten en cambios de sitio dentro de un predio contiguo, o entre establecimientos en cuadras urbanas adyacentes, donde se utilizan los mismos equipos, SOP, condiciones ambientales (p.ej., temperatura y humedad) y controles, así como personal común a ambos sitios de fabricación, y donde no se realiza ningún cambio en los registros de los lotes de fabricación, salvo información administrativa y la ubicación del establecimiento.
2. Documentación de las pruebas
a. Documentación química
Ubicación del nuevo sitio y registros de lotes actualizados. Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
Un lote de datos de estabilidad a largo plazo referidos en el informe anual.
b. Documentación de disolución
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
c. Documentación de bioequivalencia in vivo
Ninguna.
3. Documentación de presentación
Suplemento de los cambios bajo realización; informe anual (datos de pruebas de estabilidad a largo plazo).
C. Cambios de Nivel 3
1. Definición de nivel
Los cambios de Nivel 3 consisten en un cambio en el sitio de fabricación a un predio distinto. Un predio distinto se define como uno que no está en el mismo sitio contiguo original o donde los establecimientos no están en manzanas urbanas adyacentes. Para la clasificación como cambio de Nivel 3, se deberá usar los mismos equipos, SOP, condiciones ambientales y controles en el proceso de fabricación en el sitio nuevo, y no se puede realizar ningún cambio en los registros de los lotes de fabricación salvo información administrativa, ubicación y traducción de idioma, donde haga falta.
2. Documentación de las pruebas
a. Documentación química
Ubicación del nuevo sitio y registros de lotes actualizados.
Requisitos de liberación de la solicitud/el compendio.
Estabilidad:
Cuerpo significativo de datos disponibles:
Un lote con tres meses de datos de estabilidad acelerada referidos en un suplemento; un lote de datos de estabilidad a largo plazo referidos en el informe anual.
Cuerpo significativo de datos no disponibles:
Hasta tres lotes con tres meses de datos de estabilidad acelerada referidos en un suplemento; hasta tres lotes de datos de estabilidad a largo plazo referidos en el informe anual.
b. Documentación de disolución
Caso B: Se deberá realizar un perfil de disolución en puntos múltiples en el medio de la solicitud/el compendio a los 15, 30, 45, 60 y 120 minutos o hasta lograr una asíntota. Los perfiles de disolución del producto medicamentoso en los sitios actuales y propuestos deberán ser similares.
c. Documentación de bioequivalencia in vivo
Ninguna.
3. Documentación de presentación
Suplemento de cambios bajo realización; informe anual (datos de estabilidad a largo plazo).
V. CAMBIOS EN EL TAMAÑO DEL LOTE (CAMBIOS EN ESCALA)
Los cambios posteriores a la aprobación en el tamaño de un lote en relación al material del lote biológico de la escala fundamental/piloto a lotes de producción más grandes o más pequeños exigen la presentación de información adicional en la solicitud. La reducción en escala por debajo de las 100.000 unidades posológicas no está cubierta por esta guía. Todos los aumentos en escala deberán ser debidamente validados y, donde haga falta, inspeccionados por el personal de la agencia correspondiente.
A. Cambios de Nivel 1
1. Definición de nivel
Cambio en tamaño de lote, hasta un factor de 10 veces el tamaño del lote biológico piloto, inclusive, donde: 1) los equipos utilizados para producir los lotes de prueba tienen el mismo diseño y principios operativos; 2) los lotes se fabrican en pleno cumplimiento de las CGMP; y 3) se utilizan los mismos procedimientos operativos normalizados (SOP) y controles, así como la misma formulación y procedimientos de fabricación en los lotes de prueba y los lotes de producción a plena escala.
2. Documentación de las pruebas
a. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de los registros de lotes actualizados en el informe anual.
Un lote de estabilidad a largo plazo referido en el informe anual.
b. Documentación de disolución
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
c. Bioequivalencia in vivo
Ninguna.
3. Documentación de presentación
Informe anual (datos de estabilidad a largo plazo).
B. Cambios de Nivel 2
1. Definición de nivel
Cambios en el tamaño del lote más allá de un factor de diez veces el tamaño del lote biológico piloto, donde 1) los equipos utilizados para producir los lotes de prueba tienen el mismo diseño y principios operativos; 2) los lotes se fabrican en pleno cumplimiento de las CGMP; y 3) se utilizan los mismos SOP y controles, así como la misma formulación y procedimientos de fabricación, en los lotes de prueba y los lotes de producción a plena escala.
2. Documentación de las pruebas
a. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de registros de lotes actualizados.
Pruebas de estabilidad: un lote con tres meses de datos de estabilidad acelerada y un lote de estabilidad a largo plazo.
b. Documentación de disolución
Pruebas del Caso B.
c. Bioequivalencia in vivo
Ninguna.
3. Documentación de presentación
Suplemento de cambios bajo realización; informe anual (datos de estabilidad a largo plazo).
VI. FABRICACIÓN
Los cambios de fabricación podrán afectar tanto a los equipos utilizados en el proceso de fabricación como el proceso en sí.
A. Equipos
1. Cambios de Nivel 1
a. Definición de cambio
Esta categoría comprende: 1) cambios de equipos no automatizados o no mecánicos a equipos automatizados o mecánicos para mover los ingredientes; y 2) cambios a equipos alternativos con el mismo diseño y principios operativos de una capacidad igual o distinta.
b. Documentación de las pruebas
i. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de registros de lotes actualizados.
Pruebas de estabilidad: Un lote de estabilidad a largo plazo.
ii. Documentación de disolución
Ninguna más allá de los requisitos de la solicitud/el compendio.
iii. Documentación de bioequivalencia in vivo
Ninguna.
c. Documentación de presentación
Informe anual (datos de estabilidad a largo plazo).
2. Cambios de Nivel 2
a. Definición de nivel
Cambio en los equipos a un diseño distinto y principios operativos distintos.
b. Documentación de las pruebas
i. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de registros de lotes actualizados.
Pruebas de estabilidad:
Cuerpo significativo de datos disponibles:
Un lote con tres meses de datos de estabilidad acelerada referidos en un suplemento; un lote de datos de estabilidad a largo plazo referidos en el informe anual.
Cuerpo significativo de datos no disponibles:
Hasta tres lotes con tres meses de datos de estabilidad acelerada referidos en un suplemento; hasta tres lotes de datos de estabilidad a largo plazo referidos en el informe anual.
ii. Documentación de disolución
Perfil de disolución del Caso C.
iii. Documentación de bioequivalencia in vivo
Ninguna.
c. Documentación de presentación
Suplemento con la aprobación anterior y justificación del cambio; informe anual (datos de estabilidad a largo plazo).
B. Proceso
1. Cambios de Nivel 1
a. Definición de nivel
Esta categoría cubre cambios en los procesos, incluyendo cambios como tiempos de mezcla y velocidades operativas dentro de las gamas de la solicitud/validación.
b. Documentación de las pruebas
i. Documentación química
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
ii. Documentación de disolución
Ninguna más allá de los requisitos de liberación de la solicitud/el compendio.
iii. Documentación de bioequivalencia in vivo.
Ninguna.
c. Documentación de presentación
Informe anual.
2. Cambios de Nivel 2
a. Definición de nivel
Esta categoría incluye cambios en los procesos, incluyendo cambios como tiempos de mezcla y velocidades operativas fuera de las gamas de la solicitud/validación.
b. Documentación de las pruebas
i. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de registros de lotes actualizados.
Pruebas de estabilidad: Un lote de estabilidad a largo plazo.
ii. Documentación de disolución
Perfil de disolución del Caso B.
iii. Documentación de bioequivalencia in vivo
Ninguna.
c. Documentación de presentación
Suplemento de cambios bajo realización; informe anual (datos de estabilidad a largo plazo).
3. Cambios de Nivel 3
a. Definición de nivel
Esta categoría incluye cambios en el tipo de proceso utilizado en la fabricación del producto, como el cambio del granulado húmedo a la compresión directa del polvo seco.
b. Documentación de las pruebas
i. Documentación química
Requisitos de liberación de la solicitud/el compendio. Notificación del cambio y presentación de los registros de lotes actualizados.
Pruebas de estabilidad:
Cuerpo significativo de datos disponibles:
Un lote con tres meses de datos de estabilidad acelerada referidos en un suplemento; un lote de datos de estabilidad a largo plazo referidos en el informe anual.
Cuerpo significativo de datos no disponibles:
Hasta tres lotes con tres meses de datos de estabilidad acelerada referidos en un suplemento; hasta tres lotes de datos de estabilidad a largo plazo referidos en el informe anual.
ii. Documentación de disolución
Disolución del Caso B.
iii. Documentación de bioequivalencia in vivo
Estudio de bioequivalencia in vivo. Puede haber una exención para el estudio de bioequivalencia si se ha verificado una correlación in vivo/in vitro adecuada.
c. Documentación de presentación
Suplemento con la aprobación anterior; informe anual (datos de estabilidad a largo plazo).
VII. DISOLUCIÓN IN VITRO
Véase la Farmacopea estadounidense/Formulario nacional, sección 711> en vigencia para las especificaciones generales de disolución. Todos los perfiles deberán realizarse en por lo menos 12 unidades posológicas individuales.
Se puede comparar los perfiles de disolución usando la siguiente ecuación que define un factor de similitud (f2):
f2 = 50 LOG {[1 + 1/n 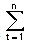
donde Rt y Tt representan el porcentaje disuelto en cada punto temporal. Un valor f2 de entre 50 y 100 sugiere que los dos perfiles de disolución son similares.
VIII. ESTUDIOS DE BIOEQUIVALENCIA IN VIVO
A continuación se encuentra un bosquejo general de un estudio de bioequivalencia in vivo. Se propone como guía y el diseño del estudio real podrá variar según el fármaco y la forma posológica.
A. Objetivo:
Comparar la velocidad y la medida de absorción del producto medicamentoso cuya fabricación se ha cambiado, según lo definido en esta guía, con el producto medicamentoso fabricado antes del cambio.
B. Diseño:
El diseño del estudio deberá ser cruzado con dos períodos, dos tratamientos y una sola dosis, con un período de eliminación adecuado entre las dos fases del estudio. Se deberá asignar números iguales de sujetos a cada una de las dos secuencias posológicas en forma aleatoria.
C. Selección de sujetos:
Se deberá determinar estadísticamente el número de sujetos inscritos en el estudio de bioequivalencia para dar cuenta de la variabilidad dentro de los sujetos y lograr el intervalo de bioequivalencia actual.
D. Procedimiento:
Cada sujeto deberá recibir los dos tratamientos siguientes:
Tratamiento 1: Producto fabricado con el cambio propuesto.
Tratamiento 2: Producto fabricado antes del cambio propuesto.
Después de un ayuno nocturno de por lo menos 10 horas, los sujetos deberán recibir el Tratamiento 1 ó 2 con 240 mL de agua. No se deberá permitir que consuman alimentos sino hasta 4 horas después de la administración. Se podrá permitir agua después de la primera hora. Se les deberá servir comidas normalizadas a los sujetos comenzando a las 4 horas durante el estudio.
E. Restricciones:
Antes y durante cada fase del estudio, se podrá permitir agua ad libitum salvo 1 hora antes y después de la administración del fármaco. El sujeto deberá recibir comidas y bebidas normalizadas en horarios especificados. No se deberá consumir ningún alimento o bebida que contenga alcohol, xantina o cafeína durante 48 horas antes de cada período del estudio y hasta después de extraerse la última muestra de sangre.
F. Muestreo de sangre:
Se deberá extraer muestras de sangre en un volumen suficiente para el análisis del fármaco precursor y los metabolitos activos, de haberlos. Los horarios de muestreo deberán ser tales que se pueda capturar la Cmáx y Tmáx durante el período de absorción. Se deberá realizar el muestreo durante por lo menos tres períodos de semidesintegración para la eliminación terminal tanto del fármaco precursor como los metabolitos activos. Se deberá cosechar prontamente la sangre entera, el plasma o el suero, según sea apropiado para los análisis, y se deberá congelar las muestras a -20EC o -70EC para mantener la estabilidad de las muestras.
G. Método analítico:
La metodología de ensayo seleccionada deberá asegurar especificidad, exactitud, precisión entre días y dentro del día, linealidad de curvas estándares, así como sensibilidad, recuperación y estabilidad adecuadas de las muestras bajo las condiciones de almacenamiento y manipulación asociadas con el método analítico.
H. Análisis farmacocinético:
Se deberá estimar AUC0-t. AUC0-inf, Cmáx, Tmáx, Kel y t1/2 a partir de los datos de concentración y tiempo del fármaco en el plasma.
I. Análisis estadístico
Se deberá realizar un análisis de varianza apropiado para un diseño cruzado en los parámetros farmacocinéticos usando los procedimientos de modelos lineales generales de SAS o un programa equivalente, con examen de efectos de período, secuencia y tratamiento. Se deberá calcular los intervalos de confianza del 90% para los estimados de la diferencia entre los medios cuadráticos mínimos de prueba y referencia para los parámetros farmacocinéticos (AUC0-t, AUC0-inf, Cmáx), usando el procedimiento de dos pruebas-t unilaterales.
IX. REFERENCIAS
A. Code of Federal Regulations 210.3(b)(2) and (10), 310.3(b) and (g), and 320.1(a) and (e). [Código de Reglamentos Federales 210.3(b)(2) y )10), 310.3(b) y (g), y 320.1(a) y (e).]
B. FDA/University of Maryland Manufacturing Research Contract Summary. [Resumen del Contrato de Investigación Manufacturera de la FDA/Universidad de Maryland.]
C. Federal Register [Registro Federal]. Vol 59, No. 183, jueves, 22 de septiembre de 1994, páginas 48754-59.
D. "Guideline for Industry: Stability Testing of New Drug Substances and Products," U.S. Department of Health and Human Services, Food and Drug administration, September 1994. ["Guía para la industria: pruebas de estabilidad para sustancias y productos medicamentosos nuevos", Departamento de Salud y Servicios Humanos de los Estados Unidos, Administración de Alimentos y Drogas, septiembre de 1994.]
E. "Guideline for Submitting Documentation for the Manufacture of and Controls for Drug Products," U.S. Department of Health and Human Services, Food and Drug Administration, February 1987. ["Guía para presentar documentación para la fabricación y controles de productos medicamentosos", Departamento de Salud y Servicios Humanos, Administración de Alimentos y Drogas, febrero de 1987.]
F. Policy and Procedure Guide #22-90: "Interim Policy on Exceptions to the Batch-Size and Production Condition Requirements for Non-Antibiotic, Solid, Oral-Dosage Form Drug Products Supporting Proposed ANDA's," U.S. Department of Health and Human Services, Center for Drug Evaluation and Research, Office of Generic Drugs, September 13, 1990. [Policy Guía de políticas y procedimientos #22-90: "Política interina de excepciones a los requisitos de tamaño de lote y condiciones de producción para productos medicamentosos de forma posológica oral, sólida y no antibiótica como respaldo de ANDA propuestas", Departamento de Salud y Servicios Humanos de los Estados Unidos, Centro de Evaluación e Investigación de Fármacos, Oficina de Fármacos Genéricos, 13 de septiembre de 1990.]
G. Workshop Report: Scale up of Immediate Release Oral Solid Dosage Forms [Informe de taller: Aumento en escala de formas posológicas sólidas orales de liberación inmediata], Pharmaceutical Research, 10 (2): 313-16, Skelly et al.
PRESENTADO POR:
Allen Rudman
Presidente, Grupo de Trabajo de SUPAC
APROBADO POR:
Roger L. Williams, Dr.Med.
Presidente, CMC CC
Apéndice A
Fármacos con gamas terapéuticas angostas
Aminofilina, comprimidos, comprimidos de ER
Carbamazepina, comprimidos, suspensión oral
Clorhidrato de clindamicina, cápsulas
Clorhidrato de clonidina, comprimidos
Clonidina, parches transdérmicos
Difilina, comprimidos
Fosfato de disopiramida, cápsulas, cápsulas de ER
Etinilestradiol/progestín, comprimidos anticonceptivos orales
Sulfato de guanetidina, comprimidos
Mesilato de isoetarina, aerosol para inhalación
Sulfato de isoproterenol, comprimidos
Carbonato de litio, cápsulas, comprimidos, comprimidos de ER
Sulfato de metaproterenol, comprimidos
Minoxidil, comprimidos
Oxitrifilina, comprimidos, comprimidos de DR, comprimidos de ER
Fenitoína sódica, cápsulas (inmediatas o prolongadas), suspensión oral
Clorhidrato de prazosín, cápsulas
Primidona, comprimidos, suspensión oral
Clorhidrato de procainamida, cápsulas, comprimidos, comprimidos de ER
Sulfato de quinidina, cápsulas, comprimidos, comprimidos de ER
Gluconato de quinidina, comprimidos, comprimidos de ER
Teofilina, cápsulas, cápsulas de ER, comprimidos, comprimidos de ER
Ácido valproico, cápsulas, jarabe
Divalproex sódico, cápsulas de DR, comprimidos de DR
Warfarina sódica, comprimidos
ER - Liberación prolongada
DR - Liberación postergada
1 Esta guía ha sido preparada por el Grupo de Trabajo de Expertos en Cambios en Escala y Posteriores a la Aprobación (SUPAC) de Liberación Inmediata del Comité Coordinador de Fabricación y Controles Químicos (CMC CC) del Centro de Evaluación e Investigación de Fármacos de la Administración de Alimentos y Drogas. Esta guía es una comunicación informal bajo 21 CFR 10.90(b)(9) que refleja el mejor parecer de los empleados del CDER en este momento. No crea ni confiere ningún derecho, privilegio o beneficio para ninguna persona, ni funciona para obligar a la FDA en ninguna manera. Para ejemplares adicionales de esta guía, se puede contactar la Oficina de Asuntos del Consumidor (antiguamente Personal del Secretariado Ejecutivo), HFD-8, Centro de Evaluación e Investigación de Fármacos, 7500 Standish Place, Rockville, MD 20855 (Teléfono: 301-594-1012). También hay una versión electrónica de esta guía disponible en Internet por conexión con el servidor del protocolo de transferencia de archivos (FTP) del CDER (CDVS2.CDER.FDA.GOV).
2 Véase el Informe de taller: Aumento en escala de formas posológicas sólidas orales de liberación inmediata, Pharmaceutical Research, 10 (2): 313-16, Skelly et al; y Federal Register [Registro Federal]. Vol 59, No. 183, jueves, 22 de septiembre de 1994, páginas
Submit Comments
Submit comments on this guidance document electronically via docket ID: FDA-2013-S-0610 - Specific Electronic Submissions Intended For FDA's Dockets Management Staff (i.e., Citizen Petitions, Draft Proposed Guidance Documents, Variances, and other administrative record submissions)
If unable to submit comments online, please mail written comments to:
Dockets Management
Food and Drug Administration
5630 Fishers Lane, Rm 1061
Rockville, MD 20852
All comments should be identified with the title of the guidance.

